พันธะเคมี คืออะไร
พันธะเคมี คือ แรงยึดเหนี่ยวที่เกิดขึ้นจากการดึงดูดเข้าหากันระหว่างอนุภาคมูลฐานหรืออะตอม (Atom) ทั้งนี้ ก็เพื่อสร้างเสถียรภาพในระดับโมเลกุล จนเกิดเป็นสสารหรือสารประกอบที่มีโครงสร้างขนาดใหญ่และมีความซับซ้อนมากขึ้นในธรรมชาติ
สรุปเนื้อหา พันธะเคมี
อะตอมและธาตุต่าง ๆ ที่ถูกพบในธรรมชาติกว่า 90 ชนิด มักจะไม่มีความสเถียร (ยกเว้น ธาตุในหมู่ VIIIA หรือก๊าซเฉื่อยเท่านั้นที่มีความสเถียร สามารถคงรูปเป็นอะตอมอิสระได้ เพราะธาตุดังกล่าวมีอิเล็กตรอนวงนอกสุดเต็มตามจำนวนในแต่ละระดับชั้นของพลังงาน หรือเรียกง่าย ๆ ว่ามีเวเลนซ์อิเล็กตรอน (Valence Electron) ครบ 8 ตัว ทำให้โครงสร้างของอะตอมมีความเสถียรในตัวเองสูง)
เมื่อธาตุหรืออะตอมมีความไม่เสถียร จึงทำให้เกิดเป็นแรงยึดเหนี่ยวระหว่างอนุภาคมูลฐานหรืออะตอม (Atom) ขึ้น เพื่อทำให้โครงสร้างของตนมีเสถียรภาพ หรือมีเวเลนต์อิเล็กตรอนครบ 8 ตัว ตามกกฎออกเตต (Octet rule) ที่ว่า “อะตอมของธาตุต่าง ๆ ที่มีเวเลนซ์อิเล็กตรอนไม่เท่ากับ 8 มีแนวโน้มที่จะปรับตัวให้มีเสถียรภาพมากขึ้นโดยรวมตัวกันเองหรือรวมตัวกับอะตอมของธาตุอื่นในสัดส่วนที่ทำให้แต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเท่ากับ 8 หรือมีจำนวนอิเล็กตรอนเท่ากับแก๊สเฉื่อย” โดยยกเว้นอะตอมของธาตุไฮโดรเจน (H) ที่ต้องการเวเลนต์อิเล็กตรอนเพียง 2 ตัว เพื่อสร้างเสถียรภาพให้ตนเอง ซึ่งแรงยึดเหนี่ยวดังกล่าวเราเรียกมันว่า “พันธะเคมี”
พันธะเคมี แบ่งออกเป็น 3 ชนิด ได้แก่
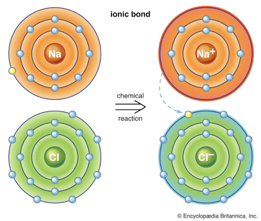
1. พันธะไอออนิก (Ionic Bond) คือ พันธะที่เกิดขึ้นจากแรงดึงดูดทางไฟฟ้าสถิตระหว่างไอออนบวก (cation) และไอออนลบ (anion) ทำการยึดเหนี่ยวอะตอมเข้าหากันโดยการเคลื่อนย้ายอิเล็กตรอนวงนอกสุดระหว่างอะตอม เพื่อทำให้เวเลนต์อิเล็กตรอนของทั้งคู่มีจำนวนเต็มตามกฎออกเตต ซึ่งโดยทั่วไปแล้วพันธะไอออนิกเป็นพันธะที่มักจะเกิดขึ้นระหว่างโลหะและอโลหะ ทั้งนี้ เนื่องจากว่าโลหะมีค่าพลังงานไอออไนเซชัน (ionization energy) ต่ำ แต่อโลหะมีค่าสัมพรรคภาพอิเล็กตรอน (electron affinity) สูง ดังนั้น โลหะจึงมีแนวโน้มที่จะให้อิเล็กตรอน และอโลหะมีแนวโน้มที่จะรับอิเล็กตรอนนั่นเอง
2. พันธะโคเวเลนต์ (Covalent Bond) คือ พันธะที่มักเกิดขึ้นจากการรวมตัวกันของอะตอมหรือธาตุในกลุ่มอโลหะ โดยการใช้เวเลนต์อิเล็กตรอน 1 คู่หรือมากกว่าร่วมกันระหว่างอะตอม ทั้งนี้ เนื่องจาก อะตอมหรือธาตุในกลุ่มอโลหะนั้นมีพลังงานไอออไนเซชันหรือแรงยึดเหนี่ยวระหว่างอิเล็กตรอนสูง ทำให้การจับคู่กันกลายเป็นการแบ่งปันอิเล็กตรอนร่วมกัน และไม่มีอะตอมตัวใดสูญเสียอิเล็กตรอนไปอย่างถาวร
พันธะโคเวเลนต์ (Covalent Bond) แบ่งแยกย่อยได้อีก 3 แบบ โดยแบ่งตามจำนวนคู่ของอิเล็กตรอนที่ใช้ร่วมกัน ดังนี้
- พันธะเดี่ยว (Single Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 1 คู่
- พันธะคู่ (Double Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 2 คู่
- พันธะสาม (Triple Bond) เกิดจากการใช้อิเล็กตรอนร่วมกัน 3 คู่

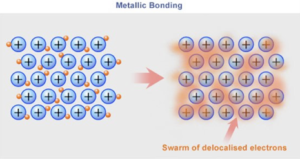
3. พันธะโลหะ (Metallic Bond) คือ แรงยึดเหนี่ยวที่เกิดขึ้นภายในอะตอมของธาตุในกลุ่มโลหะ เมื่อเกิดพันธะนี้แล้วจะเกิดการแบ่งปันอิเล็กตรอนวงนอกสุดร่วมกัน ทำให้อะตอมของกลุ่มโลหะอยู่ร่วมกันเป็นกลุ่มก้อน โดยที่อิเล็กตรอนดังกล่าวไม่ได้ถูกรวมเข้าไปเป็นส่วนหนึ่งของอะตอมใดอะตอมหนึ่งโดยเฉพาะ ซึ่งทำให้ภายในสสารหรือก้อนโลหะดังกล่าวเกิดการเคลื่อนที่ของอิเล็กตรอนอยู่ตลอดเวลา
ตัวอย่างข้อสอบ พันธะเคมี