สรุปเนื้อหา ไฟฟ้าเคมี คืออะไร
ไฟฟ้าเคมี เป็นการศึกษาเกี่ยวกับปฏิกิริยาเคมีที่ทำให้เกิดกระแสไฟฟ้า แบ่งออกเป็น 2 ประเภท ตามการถ่ายเทของอิเล็กตรอน คือ ปฏิกิริยาที่มีการถ่ายเทอิเล็กตรอน เรียกว่า ปฏิกิริยารีดอกซ์ (Redox Reaction) และปฏิกิริยาที่ไม่มีการถ่ายเทอิเล็กตรอน เรียกว่า ปฏิกิริยานอนรีดอกซ์ (Nonredox Reaction)
โดยปฏิกิริยารีดอกซ์ (Redox Reaction) ก็คือ ปฏิกิริยาที่มีการเปลี่ยนแปลงเลขออกซิเดชันของสาร โดยปฏิกิริยาเคมีไฟฟ้าสามารถแยกออกเป็นปฏิกิริยาย่อย (หรือที่เรียกว่า ครึ่งปฏิกิริยา) ได้ 2 ปฏิกิริยา ได้แก่
- ครึ่งปฏิกิริยาที่มีการให้อิเล็กตรอน เรียกว่า ปฏิกิริยาออกซิเดซัน
- ครึ่งปฏิกิริยาที่มีการรับอิเล็กตรอน เรียกว่า ปฏิกิริยารีดักซัน
ซึ่งปฏิกิริยาทั้งสองนี้จะต้องเกิดขึ้นพร้อมกัน จึงจะสามารถเรียกปฏิกิริยารวมว่า “ปฏิกิริยาออกซิเดชัน – รีดักชัน” หรือ “ปฏิกิริยารีดอกซ์” ได้ ดังนั้น จึงสรุปได้ว่าการเกิดปฏิกิริยารีดอกซ์จะต้องประกอบไปด้วย สารที่ให้อิเล็กตรอนเรียกว่าตัวรีดิวซ์ เกิดปฎิฏิกี๊ริยาออกซิเดซัน (Oxidation Reaction) และสารที่รับอิเล็กตรอนเรียกว่าตัวออกซิไดซ์ เกิดปฎิกิริยารีดักซัน (Reduction Reaction) โดยปฏิกิริยาเคมีไฟฟ้า หรือปฏิกิริยารีดอกซ์สามารถนำไปใช้ประโยชน์ในชีวิตประจำวันมากมาย เช่น การชุบโลหะ การทำแบตเตอร์รี่ การแยกสารด้วยไฟฟ้า การทำสารให้บริสุทธิ์ เป็นต้น
เลขออกซิเดชัน คืออะไร
เลขออกซิเดชัน คือ ค่าประจุไฟฟ้าที่สมมติขึ้นของไอออนหรืออะตอมของธาตุ เขียนตัวย่อได้ว่า ON. ซึ่งคิดจากจำนวนอิเล็กตรอนที่ให้, รับ หรือใช้ร่วมกับอะตอมของธาตุตามเกณฑ์ที่กำหนดขึ้น โดยเลขออกซิเดชันส่วนใหญ่จะเป็นเลขจำนวนเต็มบวกหรือลบหรือศูนย์
- ในสารประกอบไอออนิก อะตอมมีการให้และรับอิเล็กตรอนแล้วกลายเป็นไอออนบวกและไอออนลบ ดังนั้น เลขออกซิเดชันจึงตรงกับค่าประจุไฟฟ้าที่แท้จริง
ซึ่งมีค่าเท่ากับประจุไฟฟ้าของไอออนนั้นๆ
- ในสารประกอบโคเวเลนต์ อะตอมของธาตุจะใช้อิเล็กตรอนร่วมกัน ไม่ได้มีการให้และรับอิเล็กตรอนเหมือนกับในสารประกอบไอออนิก ดังนั้น ในกรณีนี้เลขออกซิเดชันจะเป็นแต่เพียงประจุสมมติ ส่วนอะตอมของธาตุใดจะมีค่าเลขออกซิเดชันเป็นบวกหรือลบ ให้พิจารณาค่าอิเล็กโทรเนกาติวิตี โดยอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีสูงกว่าจะมีเลขออกซิเดชันเป็นลบ ส่วนอะตอมของธาตุที่มีค่าอิเล็กโทรเนกาติวิตีต่ำกว่าจะมีเลขออกซิเดชันเป็นบวก ทั้งนี้ การจะมีค่าบวกเท่าไรนั้นพิจารณาได้จากจำนวนเวเลนซ์อิเล็กตรอนที่อะตอมของธาตุนำไปใช้ร่วมกับอะตอมของธาตุอื่น
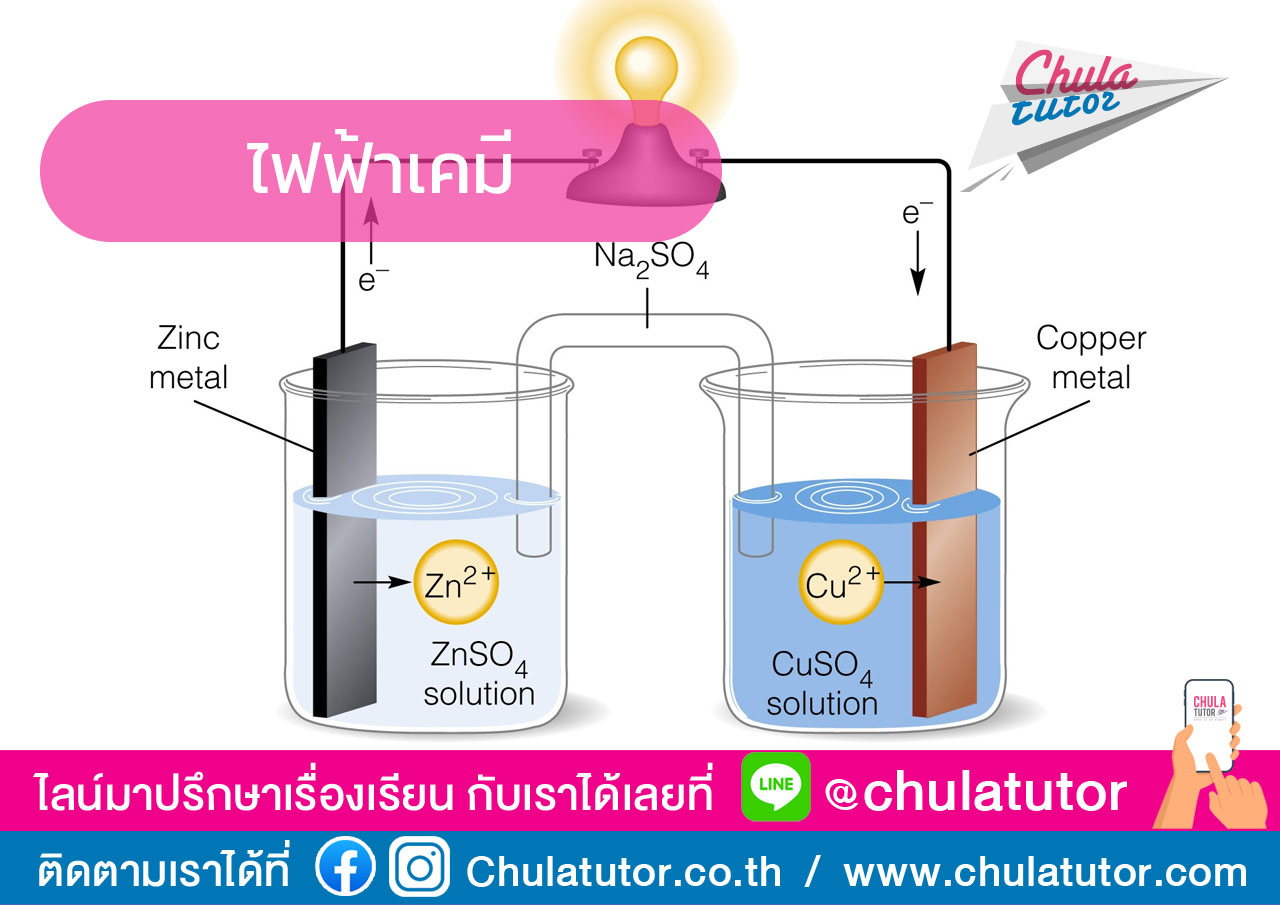
เซลล์ไฟฟ้าเคมี (Electrochemical cell) มีดังนี้
1. เซลล์กัลวานิก (Galvanic cell) คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานเคมีเป็นพลังงานไฟฟ้า เกิดจากสารเคมีทำปฏิกิริยากันในเซลล์ แล้วเกิดกระแสไฟฟ้า ประกอบด้วยครึ่งเซลล์ 2ครึ่งเซลล์มาต่อกัน และเชื่อมให้ครบวงจรโดยใช้สะพานไอออนต่อระหว่างครึ่งเซลล์ไฟฟ้าทั้งสอง เซลล์กัลวานิกมี 2
ประเภท คือ
- เซลล์ปฐมภูมิ ได้แก่ เซลล์แห้ง เซลล์แอลคาไลน์ เซลล์ปรอท
- เซลล์ทุติยภูมิ ได้แก่ แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว เซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด และเซลล์ลิเทียมไอออน
2. เซลล์อิเล็กโทรไลต์ (Electrolytic cell) คือ เซลล์ไฟฟ้าเคมีที่เปลี่ยนพลังงานไฟฟ้าเป็นพลังงานเคมี เกิดจากการผ่านกระแสไฟฟ้าเข้าไปในเซลล์ แล้วเกิดปฏิกิริยาเคมีขึ้น เช่น เซลล์แยกน้ำด้วยไฟฟ้า การซุบโลหะด้วยไฟฟ้า โดย ส่วนประกอบของเซลล์ไฟฟ้าเคมีสามารถแบ่งได้เป็น
- ขั้วไฟฟ้า คือ แผ่นตัวนำที่จุ่มในสารละลายอิเล็กโทรไลต์ แล้าต่อกับเซลล์ไฟฟ้าหรือแบตเตอรี่ แบ่งเป็นแอโนด และ แคโทด
- สารละลายอิเล็กโทรไลต์ คือ สารละลายที่นำไฟฟ้าได้ เพราะมี Iron (+) + Iron(-)
ตัวอย่างข้อสอบ ไฟฟ้าเคมี
1. ข้อใดกล่าวถูกต้องเกี่ยวกับตัวรีดิวซ์
ก. สารที่ให้อิเล็กตรอนแก่สารอื่น แล้วมีเลขออกซิเดชันเพิ่มขึ้น
ข. สารที่ให้อิเล็กตรอนแก่สารอื่น แล้วมีเลขออกซิเดชันลดลง
ค. สารที่รับอิเล็กตรอนจากสารอื่น แล้วมีเลขออกซิเดชันเพิ่มขึ้น
ง. สารที่รับอิเล็กตรอนจากสารอื่น แล้วมีเลขออกซิเดชันลดลง
2. ข้อใดกล่าวถูกต้องเกี่ยวกับตัวออกซิไดซ์
ก. สารที่ให้อิเล็กตรอนแก่สารอื่น แล้วมีเลขออกซิเดชันเพิ่มขึ้น
ข. สารที่ให้อิเล็กตรอนแก่สารอื่น แล้วมีเลขออกซิเดชันลดลง
ค. สารที่รับอิเล็กตรอนจากสารอื่น แล้วมีเลขออกซิเดชันเพิ่มขึ้น
ง. สารที่รับอิเล็กตรอนจากสารอื่น แล้วมีเลขออกซิเดชันลดลง
3. ปฏิกิริยาในข้อใดไม่ใช่ปฏิกิริยารีดอกซ์
ก. N2 + 3H2 ——-> 2NH3
ข. Mg + 2HCI ——-> MgCl2 + H2
ค. 3Cl2 + 6KOH ——-> KCIO3+ 5KCI + 3H20
ง. Na2SO4 + BaCl2 ——-> BaSO4 + 2NaCl
4. จงพิจารณาปฏิกิริยาต่อไปนี้ Cu + 2H2SO4 ——-> CuSO4 + 2H2O + SO2 ข้อใดกล่าวถูกต้อง
ก. Cu ตัวออกซิไดส์ H2SO4 ตัวรีดิวซ์
ข. Cu ตัวรีดิวซ์ H2SO4 ตัวออกซิไดส์
ค. Cu เป็นทั้งตัวออกซิไดส์ และ ตัวรีดิวซ์
ง. H2SO4 เป็นทั้งตัวออกซิไดส์ และ ตัวรีดิวซ์
5. จากปฏิกิริยารีดอกซ์ต่อไปนี้ 6Cl2 + 6Ba(OH)2 ——-> 5BaCl2 + Ba(ClO3)2 + 6H20 สารใดเป็นตัวรีดิวซ์
ก. Cl2
ข. Ba(OH)2
ค. BaCl2
ง. Ba(ClO3)2