ปริมาณสารสัมพันธ์ คืออะไร
ปริมาณสารสัมพันธ์ (Stoichiometry) มาจากการผสมภาษากรีก โดยคำว่า “stoicheion แปลว่า ธาตุ” ส่วนคำว่า “metron แปลว่า การวัด” ดังนั้น ปริมาณสารสัมพันธ์ จึงหมายถึง การวัดปริมาณของสารต่าง ๆ โดยเฉพาะปริมาณของสารที่เกี่ยวข้องกับการเกิดปฏิกิริยาเคมีทั้งของสารตั้งต้นและสารผลิตภัณฑ์ตลอดจนปริมาณของพลังงานของสารที่เปลี่ยนแปลงในปฏิกิริยาเคมี
สรุปเนื้อหา ปริมาณสารสัมพันธ์
การศึกษาเรื่องปริมาณสารสัมพันธ์ (Stoichiometry) จะช่วยให้สามารถคาดคะเนหรือคำนวณปริมาณของสารที่ต้องใช้เป็นสารตั้งต้น (reactant) เพื่อให้ได้ปริมาณสารผลิตภัณฑ์ (product) ตามต้องการ หรือใช้บอกว่าสารตั้งต้นจะทำปฏิกิริยาหมดหรือมีเหลือ และปฏิกิริยาจะได้ผลผลิตอย่างมากที่สุดเท่าใด ดังนั้น เราจึงจำเป็นต้องรู้เรื่องต่าง ๆ ที่เกี่ยวข้องทั้งหมด ไม่ว่าจะเป็นมวลอะตอม มวลโมเลกุล โมล สูตรเคมี สมการเคมี และการคำนวณจากสมการเคมี ดังนี้
มวลอะตอม คือ มวลหรือน้ำหนักเปรียบเทียบ (relative mass หรือ relative weigh)โดยเปรียบเทียบกับมวลของอะตอมมาตรฐาน กล่าวคือ เป็นการบอกให้ทราบว่า 1 อะตอมของธาตุนั้นหนักเป็นกี่เท่าของธาตุมาตรฐานนั่นเอง ซึ่งหน่วยของมวลเปรียบเทียบ คือ หน่วยมวลอะตอม (amu) หรือดาลตัน (D) โดยที่

โมเลกุลของธาตุเกิดจากอะตอมชนิดเดียวกันมาอยู่รวมกัน ส่วนโมเลกุลของสารประกอบเกิดจากอะตอมต่างชนิดกันมารวมกัน อย่างไรก็ตาม เนื่องจากโมเลกุลมีขนาดเล็กมาก การหามวลโมเลกุลจึงใช้วิธีการเปรียบเทียบกับธาตุมาตรฐานเช่นเดียวกับมวลอะตอม ดังนั้น มวลโมเลกุล จึงเป็นมวลเปรียบเทียบว่าสารนั้น 1 โมเลกุล มีมวลเป็นกี่เท่าของ 1/12 มวลของคาร์บอน – 12 1 อะตอม เช่น ก๊าซไนโตรเจนมีมวลโมเลกุล 28 หมายความว่า ก๊าซไนโตรเจน 1 โมเลกุลมีมวลเป็น 28 เท่าของ 1/12 มวลของคาร์บอน – 12 1 อะตอม
มวลโมเลกุลของสาร สามารถหาได้จากผลบวกของมวลอะตอมของธาตทั้งหมดในโมเลกุลนั้น เช่น

โมล (mole) เป็นหน่วยที่ใช้ในการบอกปริมาณสาร โดยที่

นอกจากนี้ จำนวนโมลของสาร ยังสามารถคำนวณหาได้จากสูตร

สูตรเคมี (Chemical formular) คือ กลุ่มสัญลักษณ์ของธาตุหรือสารประกอบ ซึ่งแบ่งได้ ดังนี้
- สูตรเอมพิริคัล (Empirical formular) เป็นกลุ่มสัญลักษณ์ที่เขียนแทนอัตราส่วนอย่างต่ำของจำนวนอะตอมที่ประกอบขึ้นเป็นสารประกอบนั้น
- สูตรโมเลกุล (Molecular formula) เป็นกลุ่มสัญลักษณ์ที่เขียนแทนธาตุหรือสารประกอบ เพื่อแสดงว่าธาตุหรือสารประกอบนั้น 1 โมเลกุล ประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอม กล่าวคือ สูตรโมเลกุล = (สูตรเอมพิริคัล)n เมื่อn = 1, 2, 3, … นั่นเอง
- สูตรโครงสร้าง (Structural formula) เป็นสูตรโมเลกุลที่เขียนสแดงการเชื่อมต่อ หรือการเกิดพันธะ ของอะตอมในโมเลกุลนั้น ๆ
ทั้งนี้ เราสามารถคำนวณหาสูตรเอมพิริคัลและสูตรโมเลกุลได้ ตัวอย่างเช่น

สมการเคมี (Chemical Equation) จะใช้เขียนแทนปฏิกิริยาเคมี กล่าวคือ เมื่อมีการเปลี่ยนแปลงโครงสร้างหรือองค์ประกอบของสารจากชนิดหนึ่งไปเป็นอีกชนิดหนึ่ง เราเรียกสิ่งนี้ว่า ปฏิกิริยาเคมี หรือChemical Reaction โดยสารที่เข้าทำปฏิกิริยา จะเรียกว่า ตัวทาปฏิกิริยา (reactant) และสารที่เกิดขึ้นใหม่ จะเรียกว่า สารผลิตภัณฑ์ (product) ดังนี้
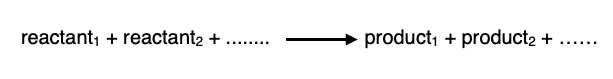
โดยสมการเคมีที่สมบูรณ์จะต้องระบุสถานะของสารว่าเป็น s, l, g หรือ aq และมีการดุลจำนวนอะตอมและประจุตามกฏทรงมวล
สมการเคมีแบ่งการเขียนออกเป็น 2 แบบ ได้แก่
1. สมการแบบโมเลกุล ซึ่งจะแสดงโมเลกุลของสารในปฏิกิริยา เช่น
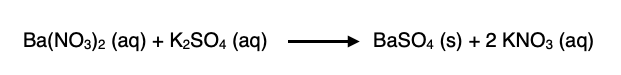
2. สมการไอออนิก นิยมเขียนแสดงปฏิกิริยาที่มีสารประกอบไอออนิกซึ่งแตกตัวเป็นไอออนในสารละลายได้ ซึ่งในบางครั้งอาจเขียนเฉพาะส่วนของสารที่เข้าทำปฏิกิริยา สำหรับสารที่ไม่ละลาย สารที่ตกตะกอน หรือแก๊ส ให้เขียนเป็นสูตรโมเลกุล เช่น
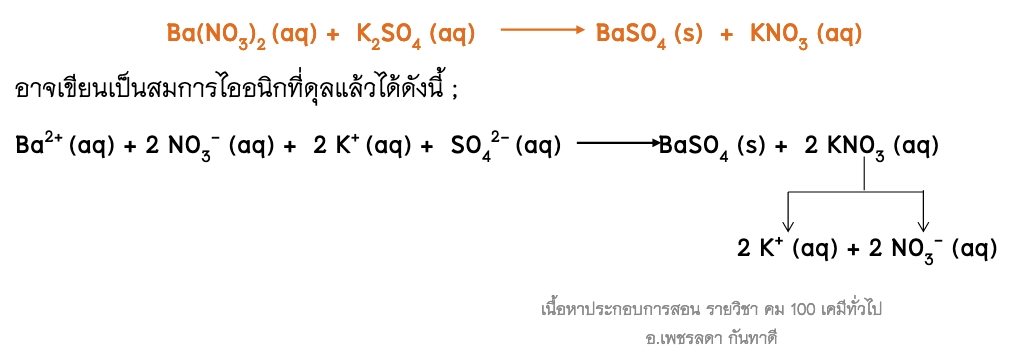
จากรูปแบบสมการทั้งหมด ตัวเลขที่อยู่หน้าสารในสมการเคมีที่ดุลแล้วจะแสดงถึงจำนวนโมลของสารที่ทำปฏิกิริยากันพอดี และจำนวนโมลของผลิตภัณฑ์ที่เกิดขึ้น
สรุปสูตร ปริมาณสารสัมพันธ์และสารละลาย





ตัวอย่างข้อสอบ ปริมาณสารสัมพันธ์
1. แก๊สชนิดหนึ่งประกอบด้วยคาร์บอน 27.3 % และที่เหลือเป็นออกซิเจนโดยมวล ถ้าสารประกอบนี้ 350 cm3 ที่ STP หนัก 0.69 กรัม จงหาสูตรโมเลกุล (C = 12 , O = 16) (2 คะแนน)
ก. CO
ข. CO2
ค. C2O4
ง. C3O2
2. ถ้าแก๊ส X มีความหนาแน่น 0.5 gdm-3 และแก๊ส Y มีความหนาแน่น 0.9 gdm-3 ที่ STP อยากทราบว่าถ้านำแก๊ส X และแก๊ส Y มาอย่างละเท่ากัน คือ 10 โมล แก๊ส X จะมีมวลเป็นกี่เท่าของแก๊ส Y (2 คะแนน)
ก. 4.5
ข. 2.5
ค. 1.6
ง. 0.56
3. ธาตุ ก ประกอบด้วย 2 ไอโซโทป ที่มีมวลอะตอม 14.0 และ 15.0 ตามลำดับ ถ้ามวลอะตอมเฉลี่ยของธาตุ ก เท่ากับ 14.10 ปริมาณร้อยละในธรรมชาติของธาตุ ก ที่มีมวลอะตอม 15.0 มีค่าเท่าใด
ก. 5
ข. 10
ค. 15
ง. 20
4. สารประกอบ ( NH4 )2HPO4 79.2 g มีธาตุไฮโดรเจนเป็นองค์ประกอบกี่โมล ( P = 31 )
ก. 2.4
ข. 2.7
ค. 4.8
ง. 5.4
5. ถ้ากำมะถัน 30 กรัม ทำปฏิกิริยากับออกซิเจน 40 กรัม ปรากฎว่าได้ออกไซด์ 60 กรัม กับออกซิเจน 10 กรัม อยากทราบว่ามีอัตราส่วนโดยมวลของ S:O เป็นเท่าไหร่
ก. 2 : 3
ข. 2 : 1
ค. 3 : 4
ง. 1 : 1