อัตราการเกิดปฏิกิริยาเคมี คืออะไร
อัตราการเกิดปฏิกิริยาเคมี คือ ความเร็วที่ตัวทำปฏิกิริยาเปลี่ยนไปเป็นสารผลิตภัณฑ์ต่อหน่วยเวลา โดยที่หน่วยความเข้มข้นของสารเป็น mol/dm3 ดังนั้น อัตราการเกิดปฏิกิริยาเคมีจึงมีการเปลี่ยนแปลงความเข้มข้นของสารต่อวินาที ชั่วโมง หรือวัน ทั้งนี้ ขึ้นอยู่กับปฏิกิริยาเกิดเร็วหรือช้านั่นเอง
สรุปเนื้อหา อัตราการเกิดปฏิกิริยาเคมี
อัตราการเกิดปฏิกิริยาเคมี สามารถจำแนกตามชนิดของปฏิกิริยา ได้ 2 ประเภท ได้แก่
1. ปฏิกิริยาเนื้อเดียว (homogeneous reaction) ซึ่งจัดเป็นปฏิกิริยาที่สารตั้งต้นทั้งหมดอยู่ในสถานะเดียวกัน
CH4(g)+ 2O2(g)—->CO2(g) + 2H2O(g)
2. ปฏิกิริยาเนื้อผสม (heterogeneous reaction) จัดเป็นปฏิกิริยาที่สารต่าง ๆ ไม่ได้อยู่ในสถานะเดียวกัน
3HCl(aq) + HNO3(aq)—>Cl2(g) + NOCl(g) + 2H2O(l)
หมายเหตุ : การทราบชนิดของปฏิกิริยาจะทำให้ศึกษาปัจจัยที่มีผลต่ออัตราการเกิดปฏิกิริยานั้นได้ง่ายขึ้น
นอกจากนี้ ยังสมารถแบ่งประเภทอัตราการเกิดปฏิกิริยาเคมี ได้เป็น 3 แบบ ได้แก่
1. อัตราการเกิดปฏิกิริยาเฉลี่ย (Average rate) คือ อัตราการเกิดปฏิกิริยาที่คิดจากการเปลี่ยนแปลงปริมาณสารตั้งต้นที่ลดลง หรือการเปลี่ยนแปลงปริมาณสารผลิตภัณฑ์ที่เพิ่มขึ้น ตั้งแต่เริ่มต้นปฏิกิริยาจนสิ้นสุดการเกิดปฏิกิริยา หรือสิ้นสุดการทดลองในหนึ่งหน่วยเวลา ซึ่งมีได้ค่าเดียว
2. อัตราการเกิดปฏิกิริยา ณ ขณะใดขณะหนึ่ง (Instantaneous rate) คือ อัตราการเกิดปฏิกิริยาที่คิดจากการเปลี่ยนแปลงปริมาณสารตั้งต้นที่ลดลง หรือการเปลี่ยนแปลงปริมาณสารผลิตภัณฑ์ที่เพิ่มขึ้น ณ ช่วงใดช่วงหนึ่ง ขณะที่ปฏิกิริยากำลังดำเนินอยู่ในหนึ่งหน่วยเวลาที่ช่วงนั้น ทั้งนี้ อัตราการเกิดปฏิกิริยานี้มีได้หลายค่า ที่เวลาต่างกันจะมีค่าไม่เท่ากัน นั่นคือ ตอนเริ่มต้นอัตราการเกิดปฏิกิริยาจะมีค่ามาก เมื่อปฏิกิริยาดำเนินต่อไป อัตราการเกิดปฏิกิริยาจะลดลงตามลำดับ เพราะความเข้มข้นของสารตั้งต้นลดลงนั่นเอง
3. อัตราการเกิดปฏิกิริยา ณ จุดใดจุดหนึ่งของเวลา คือ อัตราการเกิดปฏิกิริยาที่คิดจากการเปลี่ยนแปลงปริมาณสารตั้งต้นที่ลดลง หรือการเปลี่ยนแปลงปริมาณสารผลิตภัณฑ์ที่เพิ่มขึ้น ณ เวลาใดเวลาหนึ่งในช่วงสั้นๆ ขณะที่ปฏิกิริยากำลังดำเนินอยู่ในหนึ่งหน่วยเวลา อัตราการเกิดปฏิกิริยา ณ จุดใดจุดหนึ่งของเวลา หาได้โดยการนำข้อมูลที่ได้จากการทดลองไปเขียนกราฟ (ให้ปริมาณสารที่เปลี่ยนแปลงเป็นแกนตั้ง เวลาเป็นแกนนอน) เมื่อต้องการทราบอัตราการเกิดปฏิกิริยาที่เวลาใด ก็ให้ลากเส้นตั้งฉากตรงจุดเวลานั้นไปตัดเส้นกราฟลากเส้นสัมผัสให้ผ่านจุดตัด แล้วหาค่าความชัน (Slope) ของเส้นสัมผัส ซึ่งอัตราการเกิดปฏิกิริยา ณ ขณะนั้นก็ดูจากค่าความชันนั่นเอง
ปัจจัยทีมีผลต่ออัตราการเกิดปฏิกิริยาเคมี มีหลากหลาย ดังนี้
1. ธรรมชาติของสารตั้งต้น เพราะ สารต่างชนิดกันจะสามารถเกิดปฏิกิริยาได้เร็วหรือช้านั้น ขึ้นอยู่กับสมบัติเฉพาะตัวของสารแต่ละชนิด เช่น โลหะโซเดียมทำปฏิกิริยากับน้ำเย็นได้เร็วมาก และเกิดปฏิกิริยารุนแรง ในขณะที่โลหะแมกนีเซียมทำปฏิกิริยากับน้ำเย็นได้ช้า แต่เกิดได้เร็วขึ้นเมื่อใช้น้ำร้อน ทั้งนี้ มีสาเหตเนื่องมาจาก โลหะโซเดียมมีความว่องไวในการเกิดปฏิกิริยาดีกว่าโลหะแมกนีเซียม สารบางชนิดจะทำปฏิกิริยาได้ยาก ยกตัวอย่างเช่น การสึกกร่อนของหิน การเกิดสนิมเหล็ก แต่ในทางกลับกันบางชนิดก็ทำปฏิกิริยาได้ง่าย เช่น การระเบิดของประทัด
2. ความเข้มข้นของสารตั้งต้น เพราะโดยปกติแล้วปฏิกิริยาเคมีโดยทั่ว ๆ ไป อัตราการเกิดปฏิกิริยาเคมี มักขึ้นอยู่กับความเข้มข้นของสารตั้งต้นที่เข้าทำปฏิกิริยา เช่น ปฏิกิริยาระหว่างโลหะกับกรด ถ้าเริ่มต้นใช้กรดที่มีความเข้มข้นสูงจะเกิดการกัดกร่อนโลหะได้เร็วกว่ากรดที่มีความเข้มข้นต่ำ เป็นต้น อัตราการเกิดปฏิกิริยานั้น อาจขึ้นอยู่กับความเข้มข้นของสารตั้งต้นเพียงสารใดสารหนึ่งหรือทุกสารก็ได้ แต่อย่างไรก็ตาม ห็ยังมีมีปฏิกิริยาเคมีบางชนิดที่อัตราการเกิดปฏิกิริยาไม่ขึ้นอยู่กับความเข้มข้นของสารตั้งต้น โดยไม่ว่าจะเปลี่ยนความเข้มข้นของสารตั้งต้นอย่างไร อัตราการเกิดปฏิกิริยาคงที่เสมอ เช่น ปฏิกิริยาการกำจัดแอลกอฮอล์ในเลือดของคน เป็นต้น
3.พื้นที่ผิวของสารตั้งต้น โดยปัจจัยนี้จะมีอิทธิพลต่ออัตราการเกิดปฏิกิริยาเคมีก็ต่อเมื่อปฏิกิริยาเคมีที่เกิดขึ้นนั้นเป็นปฏิกิริยาเคมีแบบเนื้อผสมที่มีสารตั้งต้นเป็นของแข็งร่วมอยู่ด้วย เช่น การเกิดปฏิกิริยาระหว่าง Mg และ HCl กล่าวคือ ปฏิกิริยาของโลหะแมกนีเซียมกับกรดไฮโดรคลอริกจะเกิดแก๊สไฮโดรเจน ซึ่งถ้าทำให้ลวดแมกนีเซียมเป็นชิ้นเล็ก ๆ จะพบว่าปฏิกิริยานั้นเกิดเร็วกว่าลวดแมกนีเซียมที่เป็นแผ่นหรือขดเป็นสปริง
4.อุณหภูมิ โดยเมื่ออุณหภูมิสูงขึ้น อัตราการเกิดปฏิกิริยาก็จะเพิ่มขึ้นด้วย เช่น การบ่มผลไม้ในภาชนะที่มีฝาปิด จะสุกเร็วกว่าการไว้ข้างนอก
5. ตัวเร่งปฏิกิริยา (Catalyst) คือ สารที่เติมลงไปในปฏิกิริยาแล้วทำให้ปฏิกิริยาเกิดได้เร็วขึ้น หรือทำให้อัตราการเกิดปฏิกิริยาเกิดได้เพิ่มขึ้น โดยที่ตัวเร่งปฏิกิริยาอาจจะมีส่วนร่วมในการเกิดปฏิกิริยาหรือไม่ก็ได้ แต่เมื่อสิ้นสุดปฏิกิริยา ตัวเร่งปฏิกิริยาเหล่านี้จะต้องมีปริมาณเท่าเดิมและมีสมบัติเหมือนเดิม
6. ตัวหน่วงปฏิกิริยา (Inhibiter) คือ สารที่เติมลงไปในปฏิกิริยาแล้วทำให้ปฏิกิริยาเกิดช้าลง หรือทำให้อัตราการเกิดปฏิกิริยาช้าลง และเมื่อสิ้นสุดปฏิกิริยา ตัวหน่วงปฏิกิริยาจะกลับคืนมาเหมือนเดิมและมีมวลคงที่ แต่สมบัติทางกายภาพเปลี่ยนแปลงไป เช่น ขนาด รูปร่าง
โดยปกติแล้ว การเกิดปฏิกิริยาเคมีจะต้องมีพลังงานเข้ามาเกี่ยวข้องด้วย ซึ่งการดำเนินไปของปฏิกิริยาในแง่ของพลังงานของโมเลกุลเมื่อโมเลกุลของก๊าซมาชนกันจนกระทั่งกลายเป็นผลิตภัณฑ์สามารถจะแสดงให้เห็นได้โดยอาศัยกราฟซึ่งจะแสดงความสัมพันธ์ระหว่างพลังงานของสารตั้งต้นพลังงานก่อกัมมันต์ของปฏิกิริยา และพลังงานของผลิตภัณฑ์ดังนี้
ก. ปฏิกิริยาระหว่าง NO2 กับ CO ซึ่งเป็นประเภทคายความร้อน
NO2 (g) + CO(g) →NO (g) + CO2 (g) + 234 kJ
เขียนกราฟแสดงความสัมพันธ์ได้ ดังนี้
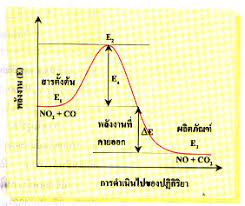
จากรูปนี้ การเปลี่ยนแปลงพลังงานของปฏิกิริยา NO2 + CO → NO + CO2
E1 คือ พลังงานของสารตั้งต้น
E3 คือ พลังงานผลิตภัณฑ์
Ea คือ พลังงานก่อกัมมันต์ซึ่งเป็นผลต่างระหว่าง E2 กับ E1
E คือ พลังงานของปฏิกิริยาซึ่งเป็นผลต่างระหว่าง E3 กับ E1
ข . ปฏิกิริยา 2HI(g) → H2 ( g) + I2 (g) ซึ่งเป็นปฏิกิริยาประเภทดูดความร้อน

กฎอัตรา คืออะไร
กฎอัตรา (Rate law) คือ สมการที่แสดงความสัมพันธ์ระหว่างอัตราการเกิดปฏิกิริยากับค่าคงที่อัตราและความเข้มข้นของสารตั้งต้น ซึ่งกฎอัตราจะมีประโยชน์มาก ถ้าเรารู้ค่าคงที่อัตราและความเข้มข้นของสารตั้งต้นแล้ว เราก็สามารถคำนวณอัตราการเกิดปฏิกิริยาจากกฎอัตราได้ ในทางกลับกัน เราสามารถที่จะใช้สมการนี้ในการหาความเข้มข้นของสารตั้งต้น ณ เวลาใดๆ ในขณะที่เกิดปฏิกิริยาได้ด้วย
กลไกของปฏิกิริยาเคมี
Elememtary reaction คือ ปฏิกิริยาที่เกิดขึ้นในขั้นตอนเดียว และอันดับของปฏิกิริยาจะเท่ากับจำนวนโมเลกุลอะตอมของสารตั้งต้นที่เข้าทำปฏิกิริยา ดังนั้น อันดับปฏิกิริยาของ Elememtary reaction จึงเรียกว่า “molecularity” โดย Elementary reaction ที่มี molecularity เป็น 1 เรียกว่า umimolecular reaction, 2 เรียกว่า bimolecular reaction และ 3 เรียกว่า termolecular reaction
หมายเหตุ : Elementary reaction ที่มี molecularity มากกว่า 2 เกิดขึ้นได้ยากมาก ดังนั้น ปฏิกิริยาใดที่มี molecularity ตั้งแต่ 2 ขึ้นไป น่าจะไม่ใช่ elementary reaction
ตัวอย่างข้อสอบ เรื่อง อัตราการเกิดปฏิกิริยาเคมี
1. CH3OH ทำปฏิกิริยากับ HCl เกิดเป็น CH3Cl และ H2O เมื่อวัดความเข้มข้นของ HCl ในขณะเกิดปฏิกิริยาได้ผลดังแสดงในตารางต่อไปนี้
| เวลา ( s) | ความเข้มข้นของ HCl ( mol/l) |
| 0
80 159 314 628 |
1.85
1.66 1.53 1.31 1.02 |
อัตราการเกิดปฏิกิริยาในช่วงเวลา 159 – 314 เป็นเท่าใด
ก. 0.0014 mol/l/s
ข. 0.0023 mol/l/s
ค. 0.0092 mol/l/s
ง. 0.0178 mol/l/s
2. จากโจทย์ข้อ 1 อัตราการเกิดปฏิกิริยา เฉลี่ยเป็นเท่าใด
ก. 0.0014 mol/l/s
ข. 0.0016 mol/l/s
ค. 0.0013 mol/l/s
ง. 0.0092 mol/l/s
3. ข้อความต่อไปนี้ข้อใดไม่ถูกต้อง
ก. คะตะไลต์เมื่อใส่ลงไปในปฏิกิริยาทำให้อัตราการเกิดปฏิกิริยาเคมีเร็วขึ้น
ข. เมื่อเพิ่มความเข้มข้นของสารตั้งต้นทำให้อัตราการเกิดปฏิกิริยาเร็วขึ้น
ค. เมื่อเกิดปฏิกิริยาคะตะไลต์อาจมีส่วนร่วมในการทำปฏิกิริยา
ง. เมื่อพลังงานกระตุ้นสูงจะทำให้เกิดปฏิกิริยาเร็วขึ้น
4. ข้อใดมีผลทำให้อัตราการเกิดปฏิกิริยาเคมีเปลี่ยนแปลงไปในทิศทางเดียวกัน
ก. เพิ่มอุณหภูมิ ลดความดัน
ข. เพิ่มพื้นที่ผิว ใส่ตัวเร่งปฏิกิริยา
ค. เพิ่มอุณหภูมิ เพิ่มขนาดภาชนะที่บรรจุ
ง. เพิ่มพื้นที่ผิว เพิ่มขนาดภาชนะที่บรรจุ
5. ปฏิกิริยา A(s) + B(aq) ———–> C(aq) + D(aq) เป็นปฏิกิริยาคายความร้อน การกระทำทั้งหมดในข้อใดทำให้อัตราการเกิดปฏิกิริยาเพิ่มขึ้น
ก. ลดขนาดของ A เติมตัวเร่งปฏิกิริยา เพิ่มอุณหภูมิ
ข. เพิ่มขนาดของ A เพิ่มความเข้มข้นของ B ลดอุณหภูมิ
ค. ลดขนาดของ A ลดความดัน เพิ่มอุณหภูมิ
ง. ลดขนาดของ A เพิ่มความเข้มข้นของ B ลดอุณหภูมิ