สรุปเนื้อหา โครงสร้างอะตอมและตารางธาตุ คืออะไร
อะตอม (Atom) เป็นหน่วยพื้นฐานของสสาร ที่ประกอบด้วยอนุภาคพื้นฐาน 3 ชนิด ได้แก่ โปรตอน นิวตรอน และอิเล็กตรอน ซึ่งข้อสรุปดังกล่าวเกิดจากการที่นักวิทยาศาสตร์ในอดีตได้พยายามศึกษาเกี่ยวกับโครงสร้างอะตอมอย่างต่อเนื่อง จนเกิดเป็นแนวความคิดและแบบจำลองอะตอมต่าง ๆ มากมายก่อนที่จะนำมาสู่ข้อสรุปเกี่ยวกับอะตอมในปัจจุบัน โดยเรียงตามวิวัฒนาการของการศึกษา ดังนี้
1. ประมาณ 500 ปีก่อนคริตักราช แนวความคิดของ ลูซิพปุส (Leucippus) และดิโมคริตุส (Democritus) มีแนวคิดว่า “อะตอม ใช้สำหรับเรียกอนุภาคที่เล็กที่สุดของสสารที่ไม่สามารถแบ่งแยกต่อไปได้อีก”
2. แบบจำลองอะตอมของดอลตัน กล่าวไว้ว่า “อะตอมมีลักษณะเป็นทรงกลมตัน ที่ไม่สามารถแบ่งแยก ทำลาย หรือสร้างใหม่ได้” ดังรูป

ซึ่งดอลตันก็ได้อธิบายแนวคิดเกี่ยวกับอะตอมไว้ 4 ข้อ ได้แก่
- สสารทุกชนิดประกอบด้วยอะตอม ซึ่งเป็นหน่วยที่เล็กที่สุด มีลักษณะเป็นทรงกลม ไม่สามารถแบ่งแยกได้อีก
- อะตอมไม่สามารถสร้างขึ้นใหม่ หรือทำลายได้
- อะตอมของธาตุชนิดเดียวกัน จะมีคุณสมบัติเหมือนกัน
- เมื่ออะตอมของธาตุต่างชนิดมารวมตัวกัน จะเกิดเป็นสารประกอบ โดยสารประกอบจะมีอัตราส่วนของธาตุเป็นเลขลงตัวจำนวนน้อยๆ
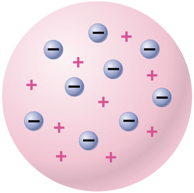
3. แบบจำลองอะตอมของทอมสัน เกิดจากการศึกษาทดลองกับหลอดรังสีแคโทดของ ของ Sir Joseph John Thomson รวมกับการทดลองของคนอื่น ๆ ไม่ว่าจะเป็น หลอดรังสีแคโทดของ William Crookers, การหาค่าประจุของอิเล็กตรอนโดยวิธีเม็ดน้ำมันของ Robert Andrews Millikan และการทดลองกับหลอดรังสีแคโทดของ Eugen Goldstrin ซึ่งทำให้ทอมสันเสนอแบบจำลองอะตอมว่า “อะตอมมีลักษณะเป็นทรงกลม ประกอบด้วยอนุภาคโปรตรอนที่มีประจุบวกและอิเล็กตรอนที่มีประจุลบกระจายอยู่ทั่วไปอย่างสม่ำเสมอ อะตอมในสภาวะเป็นกลางจะมีประจุบวกเท่ากับประจุลบ” นอกจากนี้ยังหาค่า e / m ของ hydrogas หรือ Proton ได้เท่ากับ 9.58 x 104 coulomb/ g แทนค่า e = 1.6 x 10-19 จะได้ค่ามวลของ proton = 1.66 x 10-24 g เมื่อเปรียบเทียบมวลของ proton กับมวลของ electron พบว่ามวลของ proton จะมีค่ามากกว่ามวลของ electron ประมาณ 1800 เท่า
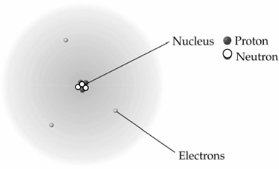
4. แบบจำลองอะตอมของรัทเทอร์ฟอร์ด เกิดจากการทดลองยิงอนุภาคแอลฟาไปที่แผ่นโลหะทองคําบาง ซึ่งพบว่า อนุภาคแอลฟาส่วนใหญ่สามารถผ่านแผ่นโลหะได้โดยมีการกระเจิงจากแนวการเคลื่อนที่เดิมไปในทิศทางต่างๆ ของอนุภาคน้อยมาก บางอนุภาคกระเจิงจากแนวเดิมเป็นมุมกว้าง และบางอนุภาคสะท้อนกลับในทิศทางเดิม จึงสรุปเกี่ยวกับแบบจำลองอะตอมของรัทเทอร์ฟอร์ด ได้ว่า “อะตอมประกอบด้วย แกนกลางที่มีความหนาแน่นของประจุบวกรวมกันอยู่ เรียกว่านิวเคลียส ซึ่งเป็นที่รวมมวลเกือบทั้งหมดของอะตอม มีอิเล็กตรอนเคลื่อนที่รอบๆ นิวเคลียส โดยมีพื้นที่ส่วนใหญ่ของอะตอมเป็นที่ว่าง และต่อมา เซอร์เจมส์ แซดวิก ก็ได้ทำการทดลองโดยการยิงอนุภาคแอลฟาไปยังอะตอมของธาตุต่าง ๆ และทดสอบผลการทดลองด้วยเครื่องมือที่มีความเที่ยงตรงสูง ทำให้มั่นใจว่า ในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าอยู่จริง และเรียกว่า “นิวตรอน”
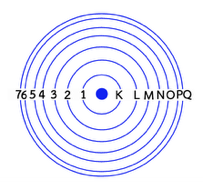
5. แบบจำลองอะตอมของบอร์ เกิดจากการที่ นีล บอห์ร (Niels Bohr) นักฟิสิกส์ชาวเดนมาร์ก ได้พยายามหาคำอธิบายเพิ่มเติมเกี่ยวกับแบบจำลองอะตอมของรัทเทอร์ฟอร์ด โดยได้พัฒนาแบบจำลองอะตอมมาจากการศึกษาการเกิดสเปกตรัมของแก๊สไฮโดรเจนและสรุปเกี่ยวกับแบบจำลองนี้ได้ว่า “อิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นวงคล้ายวงโคจรของดาวเคราะห์รอบดวงอาทิตย์ โดยแต่ละวงจะมีระดับพลังงานเฉพาะตัว ระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดนั้นมีพลังงานต่ำที่สุดเรียกว่า ระดับ K และถัดออกมาจะเป็นระดับพลังงานที่เพิ่มขึ้น วงโคจรจะมีขนาดใหญ่ขึ้น อยู่ห่างจากนิวเตลียสมากขึ้นเป็น L , M , N , … ตามลำดับ”
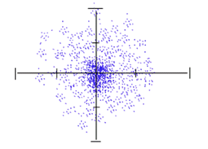
6. แบบจำลองอะตอมกลศาสตร์ควอนตัม (แบบกลุ่มหมอก)
เนื่องจากแบบจำลองอะตอมของบอร์มีข้อจำกัด เพราะใช้ได้กับอะตอมที่มีจำนวนอิเล็กตรอนน้อยๆได้ดี แต่หากเป็นอะตอมที่มีจำนวนอิเล็กตรอนมาก การโคจรรอบนิวเคลียสของอิเล็กตรอนก็จะมีความซับซ้อนมากขึ้น จึงทำให้นักฟิสิกส์ควอนตัมต่างพยายามสร้างสมการทางคณิตศาสตร์เพื่อคำนวณโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียส จนได้แบบจำลองอะตอมขึ้นมา ซึ่งอธิบายได้ว่า “อิเล็กตรอนเคลื่อนที่รอบนิวเคลียสอย่างรวดเร็ว ด้วยรัศมีไม่แน่นอนจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้ บอกได้แต่เพียงโอกาสที่จะพบอิเล็กตรอนในบริเวณต่าง ๆ ปรากฏการณ์แบบนี้เรียกว่ากลุ่มหมอกของอิเล็กตรอน บริเวณที่มีกลุ่มหมอกอิเล็กตรอนหนาแน่นจะมีโอกาสพบอิเล็กตรอนมากกว่าบริเวณที่เป็นหมอกจาง” ดังรูป
ตารางธาตุ คืออะไร
ตารางธาตุ (Periodic Table) คือ ตารางแสดงรายชื่อธาตุและสมบัติบางประการของธาตุ ซึ่งจะจัดเรียงตามลขอะตอม (จำนวนโปรตอนในนิวเคลียส) การจัดเรียงอิเล็กตรอน (electron configuration) และสมบัติของธาตุที่ซ้ำกันหรือคล้ายกันตามหมู่ ดังรูป
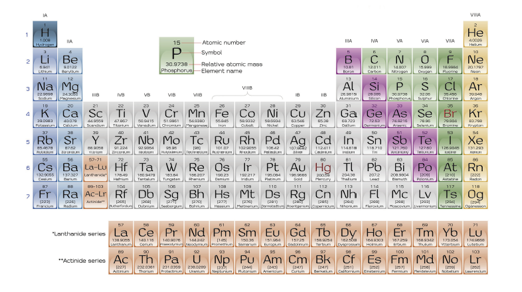
ตารางธาตุในปัจจุบันมีทั้งหมด 118 ธาตุ โดยแบ่งเป็นธาตุที่พบได้ในธรรมชาติ 98 ธาตุ ส่วนอีก 16 ธาตุตั้งแต่ธาตุที่ 99 (ไอน์สไตเนียม) จนถึงธาตุที่ 118 (ออกาเนสซอน) จะเป็นธาตุที่ถูกสังเคราะห์ขึ้นในห้องปฏิบัติการทางวิทยาศาสตร์
ธาตุแต่ละตัวจะถูกจัดเรียงจากซ้ายไปขวาและจากบนลงล่างตามเลขอะตอม (Atomic Number) หรือจำนวนโปรตอนในนิวเคลียสของธาตุ โดยตารางธาตุในปัจจุบันแบ่งธาตุทั้งหมดออกเป็น
- 18 หมู่ (Group) ตามแนวดิ่ง โดยธาตุที่มีสมบัติคล้ายกันจะถูกจัดจำแนกให้อยู่ในหมู่เดียวกัน จากการจัดเรียงเวเลนซ์อิเล็กตรอน (Valence Electron) หรือมีจำนวนอิเล็กตรอนในวงนอกสุดเท่ากัน และทั้ง 18 หมู่ในตารางธาตุมีสัญลักษณ์เป็นตัวเลขโรมันหรือเลขอารบิก จาก 1 ถึง 18 และตัวอักษร เช่น IA หรือ 1A
- 7 คาบ (Period) ในแนวนอนเป็นตัวบ่งบอกจำนวนชั้นของอิเล็กตรอน (Electron Shell) โดยจำนวนของอิเล็กตรอนและโปรตอนของธาตุในคาบเดียวกันนี้ จะเพิ่มจำนวนขึ้นทีละหนึ่งชั้น พร้อมทั้งความเป็นโลหะที่ลดลงจากธาตุหมู่ทางด้านซ้ายไปยังด้านขวาของตารางธาตุ ในขณะที่อิเล็กตรอนจะถูกจัดเรียงในชั้นใหม่ เมื่อชั้นเดิมถูกจัดเรียงจนเต็ม ซึ่งคือการเริ่มต้นของคาบใหม่ในตารางธาตุ
นอกจากนี้ในตารางธาตุยังมีการแบ่งกลุ่มตามคุณสมบัติความเป็นโลหะอีกด้วย โดยจะแบ่งได้ 3 กลุ่ม คือ
- ธาตุโลหะ (Metals) อยู่ทางด้านซ้ายของตารางธาตุ หรือ หมู่ 1A เป็นกลุ่มธาตุที่นำไฟฟ้าและนำความร้อนได้ดี
- ธาตุกึ่งโลหะ (Metalloids) อยู่บริเวณขั้นบันได โดยจะเป็นกลุ่มธาตุที่นำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้อง แต่จะนำได้ดีขึ้นเมื่อได้รับความร้อนมากขึ้น มีคุณสมบัติของทั้งธาตุในกลุ่มโลหะและธาตุอโลหะ
- ธาตุอโลหะ (Nonmetals) อยู่ด้านขวาของตารางธาตุ เป็นกลุ่มธาตุที่ไม่นำทั้งไฟฟ้าและความร้อน
สำหรับชื่อและสัญลักษณ์ของธาตุในตารางธาตุนั้น จะประกอบไปด้วยตัวลขมุมซ้ายด้านบน ตัวอักษรตรงกลาง และตัวเลขด้านล่าง ดังนี้
- ตัวเลขบนมุมซ้ายด้านบน คือ จำนวนโปรตอนภายในอะตอมของธาตุหรือเลขอะตอม (Atomic Number)
- ตัวอักษรตรงกลาง คือ อักษรย่อของชื่อธาตุ (Abbreviation) ในหลายกรณีสัญลักษณ์ที่มีชื่อภาษาอังกฤษอย่างเช่น ฮีเลียม (Helium) จะใช้ “He” เป็นตัวแทนสัญลักษณ์ของธา
- ตัวเลขด้านล่าง คือ มวลอะตอม (Atomic Mass) หรือจำนวนโปรตอนและนิวตรอนภายในนิวเคลียสของธาตุนั้นๆ
โครงสร้างอะตอมและตารางธาตุ ต้องเรียนระดับชั้นไหน
บทเรียนเรื่องโครงสร้างอะตอมและตารางธาตุ เป็นเนื้อหาของวิชาเคมี ม.4 ซึ่งจริง ๆ แล้วยังมีหัวข้ออื่น ๆ ที่เกี่ยวข้องที่ลงรายละเอียดลึกมากขึ้นอีก เช่น การจัดเรียงอิเล็กตรอน เป็นต้น
ตัวอย่างข้อสอบ โครงสร้างอะตอมและตารางธาตุ
























