เนื้อหาสรุป โมลและสูตรเคมี
โมล (mole หรือ mol) เป็นหน่วยเรียกในระบบ SI โดยสัญลักษณ์ของโมล คือ mol หมายถึง ปริมาณสารที่ประกอบไปด้วยอนุภาค (อะตอม โมเลกุล หรืออนุภาคอื่น) เท่ากับจำนวนอะตอมของไอโซโทป C-12 จำนวน 12 กรัม ซึ่งได้ว่า
1 mole = 6.02 x 1023 อนุภาค = Avogadro’s number
กล่าวคือ สารใด ๆ 1 โมล จะมีจำนวนอนุภาค (อะตอม โมเลกุล ไอออน) เท่ากับ 6.02 x 1023 อนุภาค หรือเรียกว่า Avogadro’s number ซึ่งมีมวลเท่ากับมวลอะตอมของธาตุหรือมวลโมเลกุลของสารนั้น ๆ เช่น ไนโตรเจนมีมวลอะตอมเท่ากับ 14.01 ดังนั้น ไนโตรเจร 1 โมล จะมีมวล 14.01 กรัม หรือมวลต่อโมลของไนโตรเจนเป็น 14.01 กรัมต่อโมล
ตัวอย่างของสารปริมาณ 1 โมล เช่น
| สาร | จำนวนอนุภาค |
| คริปทอน (Kr) | 6.02 x 1023 อะตอม |
| น้ำ (H2O) | H2O 6.02 x 1023 โมเลกุล H 2 x 6.02 x 1023 อะตอมO 6.02 x 1023 อะตอม |
| โซเดียมซัลเฟต Na2SO4) | Na+. 2 x 6.02 x 1023 ไอออน
SO4 2- 6.02 x 1023 ไอออน |
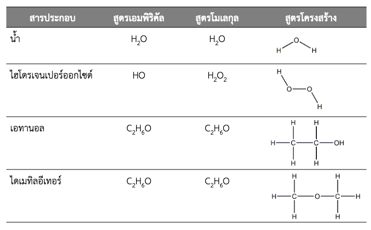
สูตรเคมี (Chemical formular) คือ กลุ่มสัญลักษณ์ของธาตุหรือสารประกอบ ซึ่งแบ่งได้ ดังนี้
1. สูตรเอมพิริคัล (Empirical formular) เป็นกลุ่มสัญลักษณ์ที่เขียนแทนอัตราส่วนอย่างต่ำของจำนวนอะตอมที่ประกอบขึ้นเป็นสารประกอบนั้น เช่น
2. สูตรโมเลกุล (Molecular formula) เป็นกลุ่มสัญลักษณ์ที่เขียนแทนธาตุหรือสารประกอบเพื่อแสดงว่าธาตุหรือสารประกอบนั้น 1 โมเลกุล ประกอบด้วยธาตุอะไรบ้าง อย่างละกี่อะตอม เช่น
กล่าวคือ สูตรโมเลกุล = (สูตรเอมพิริคัล)n เมื่อn = 1, 2, 3, … นั่นเอง
3. สูตรโครงสร้าง (Structural formula) เป็นสูตรโมเลกุลที่เขียนสแดงการเชื่อมต่อ หรือการเกิดพันธะ ของอะตอมในโมเลกุลนั้น ๆ เช่น
ตัวอย่างข้อสอบ โมลและสูตรเคมี